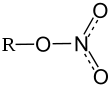
- Нитрат никеля(II)
-
Нитрат никеля(II) 
Общие Систематическое наименование Нитрат никеля(II) Традиционные названия азотнокислый никель Химическая формула Ni(NO3)2 Физические свойства Состояние (ст. усл.) светло-зелёные кристаллы Молярная масса 182,70 г/моль Плотность гидр. 2,05 г/см³ Термические свойства Температура плавления гидр. 56,7 °C Молярная теплоёмкость (ст. усл.) 86 Дж/(моль·К) Энтальпия образования (ст. усл.) -401,5 кДж/моль Химические свойства Растворимость в воде 79,20; 10025; 139,250; 180,175 г/100 мл Классификация Рег. номер CAS 13138-45-9 Рег. номер PubChem 25736 SMILES [Ni+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O Регистрационный номер EC 238-076-4 Нитрат никеля(II) — неорганическое соединение, соль металла никеля и азотной кислоты с формулой Ni(NO3)2, светло-зелёные кристаллы, хорошо растворяется в воде, образует кристаллогидраты.
Содержание
Получение
- Растворение никеля, оксида никеля(II) в разбавленной азотной кислоте:
- Растворение хлорида никеля(II) в горячей азотной кислоте:
Физические свойства
Нитрат никеля(II) образует светло-зелёные кристаллы, хорошо растворимые в воде, ацетонитриле, диметилсульфоксиде.
Образует кристаллогидраты состава Ni(NO3)2•n H2O, где n = 2, 4, 6 и 9.
Наиболее стабильный кристаллогидрат Ni(NO3)2•6H2O имеет строение [Ni(H2O)6](NO3)2.
Химические свойства
- Безводная соль при нагревании разлагается:
- Кристаллогидрат при нагревании разлагается иначе:
- Реагирует с щелочами:
- Иначе реакция идёт в растворами аммиака: с разбавленными:
- и с концентрированными:
- Является слабым восстановителем:
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
 Категории:
Категории:- Соединения никеля
- Нитраты
Wikimedia Foundation. 2010.










_2 + 6H_2O }](54343a468aa736e50ee7be5d24bbfc1c.png)