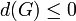- Потенциал Гиббса
-
Термодинамические потенциалы 
Статья является частью серии «Термодинамика». Внутренняя энергия Энтальпия Свободная энергия Гельмгольца Энергия Гиббса Большой термодинамический потенциал (Ω) Разделы термодинамики Начала термодинамики Уравнение состояния Термодинамические величины Термодинамические потенциалы Термодинамические циклы Фазовые переходы править Определение
Энергией Гиббса (или потенциалом Гиббса, или просто термодинамическим потенциалом в узком смысле) называют термодинамический потенциал следующего вида:
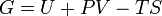 ,
,
где U — внутренняя энергия, P — давление, V — объем, T — абсолютная температура, S — энтропия. Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т.д.)
Дифференциал энергии Гиббса для системы с постоянным числом частиц:
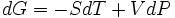 .
.
Для системы с переменным числом частиц этот дифференциал записывается так:
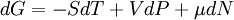 .
.
Здесь μ — химический потенциал, который можно определить как энергию, которую необходимо затратить, чтобы добавить в систему ещё одну частицу.
Можно показать, что химический потенциал есть отношение энергии Гиббса к числу частиц в системе:
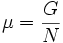 .
.
Химический потенциал применяется при анализе систем с переменным числом частиц, а также при изучении фазовых переходов.
Показажем, что минимум потенциала Гиббса соответствует устойчивому равновесию термодинамической системы с фиксированными температурой, давлением и числом частиц.
Запишем обобщенное уравнение первого и второго начал термодинамики:
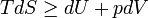 .
.
При *
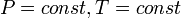 .
.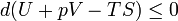 .
.
Таким образом в системе при простоянных температуре и давлении энергия Гиббса достигает минимального значения
Применение в химии
В химических процессах одновременно действуют два противоположных фактора — энтропийный (TΔS) и энтальпийный (ΔH). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (G):
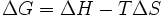 .
.
Из этого выражения следует, что
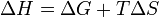 , то есть некоторое количество теплоты расходуется на увеличении энтропии (TΔS), эта часть энергии потеряна для совершения полезной работы, её часто называют связанной энергией. Другая часть теплоты (ΔG) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
, то есть некоторое количество теплоты расходуется на увеличении энтропии (TΔS), эта часть энергии потеряна для совершения полезной работы, её часто называют связанной энергией. Другая часть теплоты (ΔG) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При ΔG < 0 процесс может протекать, при ΔG > 0 процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же ΔG = 0, то система находится в состоянии химического равновесия.
Обратите внимание, что речь идёт исключительно о принципиальной возможности протекания реакции. В реальных же условиях реакция может не начинаться и при соблюдении неравенства ΔG < 0 (по кинетическим причинам).
Существует полезное соотношение, связвающее изменение свободной энергии Гиббса
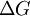 в ходе химической реакции с ее константой равновесия
в ходе химической реакции с ее константой равновесия  :
: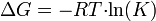
Вообще говоря, любая реакция может быть рассмотрена как обратимая (даже если на практике она таковой не является). При этом константа равновесия определяется как
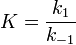
где
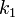 — константа скорости прямой реакции,
— константа скорости прямой реакции, 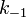 — константа скорости обратной реакции. Энергия Гиббса названа в честь одного из основателей термодинамики, Джозайя Уилларда Гиббса.
— константа скорости обратной реакции. Энергия Гиббса названа в честь одного из основателей термодинамики, Джозайя Уилларда Гиббса.Литература
- Ахметов Н. С. «Актуальные вопросы курса неорганической химии» М.: «Просвещение», 1991. 495 с. ISBN 5-09-002630-0
- Базаров И. П. Термодинамика. М.: Высшая школа, 1991. 376 с.
- Ландау, Л. Д., Лифшиц, Е. М. Статистическая физика. Часть 1. — Издание 3-е, дополненное. — М.: Наука, 1976. — 584 с. — («Теоретическая физика», том V).
Wikimedia Foundation. 2010.