- Оксид лития
-
Оксид лития 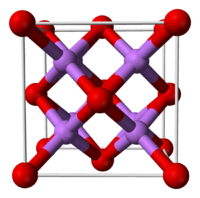
Общие Систематическое наименование Оксид лития Традиционные названия Окись лития Химическая формула Li2O Эмпирическая формула Li2O Физические свойства Состояние (ст. усл.) твёрдое Молярная масса 29,8774 г/моль Плотность 2,013 г/см³ Термические свойства Температура плавления 1570 [1] °C Температура кипения 2600 [1] °C Химические свойства Растворимость в воде 6,67 (0 °C) Классификация Рег. номер CAS 12057-24-8 RTECS OJ6360000 Окси́д ли́тия (окись лития) — бинарное неорганическое вещество, имеющее химическую формулу Li2O. Относится к классу основных оксидов.
Содержание
Описание
Оксид лития при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы с кубической решёткой. Пространственная группа F m3m, a = 0,4628 нм, Z = 4.
При температуре выше 1000 °C возгоняется, в присутствии паров воды возгонка ускоряется. В газообразном состоянии при температуре выше 1500 °C оксид лития частично диссоциирует на Li и O2. Диамагнитен. С водородом, кислородом, углеродом и монооксидом углерода не взаимодействует даже при нагревании. При высоких температурах реагирует с большинством металлов, за исключением золота, платины и никеля. При действии магния, алюминия или марганца при температуре выше 1000 °C оксид лития восстанавливается до металлического лития. С оксидами ряда металлов дает оксометаллаты, двойные и тройные оксиды. Оксид лития — единственный среди оксидов щелочных металлов, образующийся в качестве основного продукта при нагревании металла выше 200 °C на воздухе (присутствуют только следы пероксида лития).[2]
Получение
- Взаимодействие металлического лития с кислородом:
- Разложение пероксида лития при температуре 195 °C:
Химические свойства
- Взаимодействует с водой, образуя щёлочь:
- с кислотами:
- литий из окисла вытесняется некоторыми металлами и неметаллами:
- с кислотообразующими оксидами образует соли:
Применение
Оксид лития применяют в качестве добавки к смесям реагентов при твердофазном синтезе двойных и тройных оксидов для понижения температуры процесса; как компонент в производстве специальных стёкол (в частности, с небольшим температурным коэффициентом линейного расширения и рентгенопрозрачных), глазурей и эмалей, повышающий их химическую и термическую стойкость, прочность и снижающий вязкость расплавов. Также используется в термобарьерных покрытиях вместе с иттрием и цирконием как показатель уменьшения покрытия.
См. также
Примечания
Для улучшения этой статьи желательно?: - Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
Соединения литияАзид лития (LiN3) • Алюминат лития (LiAlO2) • Алюмогидрид лития (LiAlH4) • Амид лития (LiNH2) • Ацетат лития (CH3COOLi) • Ацетиленид лития (Li2C2) • Бензиллитий (LiСH2С6H5) • Бензоат лития (C6H5COOLi) • Бромат лития (LiBrO3) • Бромид лития (LiBr) • Гексафторфосфат лития (LiPF6) • Гидрид лития (LiH) • Гидрокарбонат лития (LiHCO3) • Гидроксид лития (LiOH) • Гидроортофосфат лития (Li2HPO4) • Гидросульфат лития (LiHSO4) • Гидросульфид лития (LiHS) • Гидрофторид лития (LiHF2) • Дигидроортофосфат лития (LiH2PO4) • Дисульфит лития (Li2S2O5) • Дихромат лития (Li2Cr2O7) • Имид лития (Li2NH) • Иодат лития (LiIO3) • Иодид лития (LiI) • Карбид лития (Li2С2) • Карбонат лития (Li2CO3) • Метагерманат лития (Li2GeO3) • Метасиликат лития (Li2SiO3) • Метафосфат лития (LiPO3) • Метиллитий (LiСH3) • Нитрат лития (LiNO3) • Нитрид лития (Li3N) • Нитрит лития (LiNO2) • Оксалат лития (Li2C2O4) • Оксид лития (Li2O) • Ортофосфат лития (Li3PO4) • Пербромат лития (LiBrO4) • Пероксид лития (Li2O2) • Пероксомоносульфат лития (Li2SO5) • Персульфат лития (Li2S2O8) • Перхлорат лития (LiClO4) • Силицид лития (Li6Si2) • Сорбат лития (C6H7LiO2) • Сульфат лития (Li2SO4) • Сульфид лития (Li2S) • Сульфит лития (Li2SO3) • Тетрагидридоалюминат лития (Li[AlH4]) • Тетрагидридоборат лития (Li[BH4]) • Тиоцианат лития (LiSCN) • Фениллитий (LiС6H5) • Формиат лития (HCOOLi) • Фталимид лития • Фторид лития (LiF) • Хлорат лития (LiClO3) • Хлорид лития (LiCl) • Хромат лития (Li2CrO4) • Цианат лития (LiOCN) • Цианид лития (LiCN) • Цианоаурат лития (Li[Au(CN)2] • Этиллитий (LiС2H5) •
 Категории:
Категории:- Соединения лития
- Твёрдое тело
- Основные оксиды
Wikimedia Foundation. 2010.







