- Оксид олова(II)
-
Оксид олова(II) 
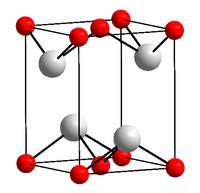
Общие Систематическое наименование оксид олова(II) Традиционные названия монооксид олова; олово окись(II); олово закись; олово одноокись Химическая формула SnO Физические свойства Состояние (ст. усл.) чёрный порошок Молярная масса 134.71 г/моль Плотность 6.45 г/см³ Термические свойства Температура плавления (при 80 кПа) 1080 °C °C Температура кипения 1425 °C Температура вспышки негорюч °C Молярная теплоёмкость (ст. усл.) 47,8 Дж/(моль·К) Энтальпия образования (ст. усл.) -285,98 кДж/моль Химические свойства Растворимость в воде нерастворим Структура Кристаллическая структура тетрагональная Классификация Рег. номер CAS 21651-19-4 RTECS XQ3700000 Безопасность Токсичность при вдыхании вызывает кашель[1] Оксид олова(II) — это неорганическое бинарное химическое соединение, которое существует в двух формах: стабильная, имеющая черно-синий (по другим данным коричневато-чёрный[1]) цвет и метастабильная — красный цвет. Химическая формула — SnO. В этом соединении олово имеет степень окисления равную 2+, а кислород 2−.
Содержание
Физические свойства
Темно-синее (почти чёрное) кристаллы, тетрагональная сингония, структура типа РbО (а = 0,3802 нм, с = 0,4837 нм, Z = 2, пространственная группа P42/nmm). При давлении выше 90 ГПа (900 тыс. атм) переходит в ромбическую модификацию (а = 0,382 нм, b = 0,361 нм, с = 0,430 нм, Z = 2, пространственная группа Рm2n).
Оксид олова является полупроводником, тип проводимости которого зависит от примесей и способа получения.
Получение
Оксид олова получают осторожным разложением в инертной атмосфере гидроокиси олова:
Из диоксида олова:
В лабораторных условиях оксид олова часто получают осторожным нагревом оксалата олова(II) в инертной атмосфере:
С помощью твёрдотельной реакции из хлорида олова(II):
Метастабильный красный оксид олова(II) можно приготовить подогревая на малом огне водный раствор аммиака с оловом2+, в результате получится осадок, состоящий из красного оксида олова(II).
Химические свойства
Оксид олова(II) устойчив на воздухе, амфотерен с преобладанием основных свойств. Мало растворим в воде и разбавленных растворах щелочей. Растворяется в разбавленных кислотах:
и концентрированных кислотах:
Он также растворяется в сильных кислотах, давая ионные комплексы, например Sn(OH2)32+ или Sn(OH)(OH2)2+, также в менее кислотных растворах — Sn3(OH)42+.
Растворяется в концентрированных щелочах:
Также известны другие безводные оловосодержащие соединения, например, K2Sn2O3, K2SnO2.
Диспропорционирует при нагревании:
Окисляется кислородом воздуха:
Восстанавливается до металлического олова водородом, углеродом, кремнием, бором и парами этилового спирта.[2]:
Sn и O могут образовывать соединения нестехиометрического состава.
Применение
Оксид олова(II) в подавляющем большинстве случаев используется в качестве исходного продукта в производстве других, как правило, двухвалентных, соединений олова. Может применяться также в качестве восстановителя и в создании рубинового стекла. В незначительных количествах используется в качестве этерификаторного катализатора.
Оксид церия(III) с оксидом олова(II) используется в осветительных приборах как люминофор.
Примечания
- ↑ 1 2 Информационный источник №1. Проверено 29 марта 2010.
- ↑ Сайт www.onx.distant.ru.(недоступная ссылка — история) Проверено 29 марта 2010.
Соединения оловаАцетат олова (Sn(OCOCH3)2) • Бромид олова(II) (SnBr2) • Бромид олова(IV) (SnBr4) • Гексагидроксостаннат(IV) натрия (Na2[Sn(OH)6]) • Гексафенилолово (Sn2(C6H5)6) • Гексахлоростаннат(IV) аммония ((NH4)2[SnCl6]) • Гексахлоростаннат(IV) водорода (H2[SnCl6]) • Гексахлоростаннат(IV) калия (K2[SnCl6]) • Гексахлоростаннаты • Гидроксид олова(II) (Sn(OH)2) • Гидрофосфат олова (Sn(H2PO4)2) • Дифенилолово (Sn(C6H5)2) • Диэтилолово (Sn(C2H5)2) • Иодид олова(II) (SnI2) • Иодид олова(IV) (SnI4) • Нитрат олова(II) (Sn(NO3)2) • Нитрат олова(IV) (Sn(NO3)4) • Оксалат олова (SnC2O4) • Оксид олова(II) (SnO) • Оксид олова(IV) (SnO2) • Перхлорат олова (Sn(ClO4)2) • Пирофосфат олова (Sn2P2O7) • Селенид олова(II) (SnSe) • Селенид олова(IV) (SnSe2) • Станнан (SnH4) • Станнин (Cu2FeSnS4) • Сульфат олова(II) (SnSO4) • Сульфат олова(IV) (Sn(SO4)2) • Сульфид олова(II) (SnS) • Сульфид олова(IV) (SnS2) • Теллурид олова (SnTe) • Фосфат олова(II) (Sn3(PO4)2) • Фторид олова(II) (SnF2) • Фторид олова(IV) (SnF4) • Хлорид олова(II) (SnCl2) • Хлорид олова(IV) (SnCl4)
Категории:- Соединения олова
- Соединения кислорода
- Бинарные соединения
- Неорганические вещества
- Амфотерные оксиды
Wikimedia Foundation. 2010.






![~\mathsf{SnO + 3HCl \xrightarrow{} H[SnCl_3] + H_2O }](277d427f2ecaa5862149ecaeb69da98b.png)
![~\mathsf{SnO + NaOH + H_2O \stackrel{20^oC}{\rightleftarrows} Na[Sn(OH)_3] }](5a8b3e665ae427e1f4698ec2c715e824.png)



