- Формальный заряд
-
Сте́пень окисле́ния (окислительное число, формальный заряд) — вспомогательная, условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Степень окисления соответствует заряду иона или формальному заряду атома в молекуле или в химической формальной единице, например:
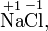
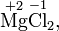
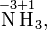
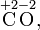
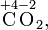
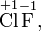
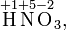
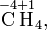
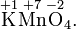
Степень окисления указывается сверху над символом элемента. В отличие от указания заряда атома, при указании степени окисления первым ставится знак, а потом численное значение, а не наоборот:
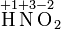 — степень окисления,
— степень окисления,
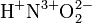 — заряды.
— заряды.Степень окисления атома в простом веществе равна нулю, например:
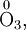
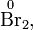
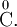
Алгебраическая сумма степеней окисления атомов в молекуле всегда равна нулю:
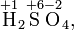
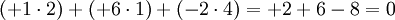
Степень окисления в ряде случаев не совпадает ни с валентностью (например, в органических соединениях углерод всегда четырёхвалентен, а степень окисления атома углерода в соединениях CH4, CH3OH, HCOOH соответственно равно −4, −2 и +2), ни с фактическим числом электронов, которые участвуют в образовании связей.
Понятие степени окисления вполне применимо и для нестехиометрических соединений (КС8, Mo5Si3, Nb3B4 и др.). Например в известной реакции обжига пирита:
4FeS2 +11O2 = 2Fe2O3 + 8SO2
удобнее всего принять в исходном соединение степень окисления у железа +3, а у серы -3/2 (!), что совсем не противоречит определеню степени окисления, как условной единицы и позволяет так же просто, как и в случае других окислительно-восстановиельных процессов, уровнять реакцию.См. также
Ссылки
Wikimedia Foundation. 2010.
