- Оксид хлора (IV)
-
Оксид хлора(IV) 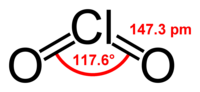
Общие Систематическое наименование Оксид хлора(IV) Химическая формула ClO2 Отн. молек. масса 67.45 а. е. м. Молярная масса 67.45 г/моль Физические свойства Состояние (ст. усл.) газ Термические свойства Температура плавления −59 °C Температура кипения 9.7 °C Энтальпия (ст. усл.) +104.60 кДж/моль Классификация номер CAS 10049-04-4 номер EINECS 233-162-8
Окси́д хло́ра(IV) (диоксид хлора) ClO2 — газ красновато-жёлтого цвета, с характерным запахом. При температурах ниже 10 °C ClO2 представляет из себя жидкость красно-коричневого цвета. Малоустойчив, взрывается на свету, при контактах с окислителями и при нагревании. Хорошо растворим в воде. Теплота испарения диоксида хлора 6.3 ± 0.1 ккал/моль, критическая температура 192°C, критическое давление 85 атм. Плотность ClO2 уменьшается от 1.973 г/см3 при –60°C до 1.653 г/см3 при 5°C. Диоксид хлора растворим в воде, уксусной и серной кислотах, в четыреххлористом углероде, ацетонитриле, а также в ряде других органических растворителей. Растворимость диоксида хлора возрастает с ростом полярности растворителя. Потенциал ионизации диоксида хлора равен 10.33 ± 0.02 эВ, сродство к электрону 2.378 ± 0.006 эВ. Потенциал окисления-восстановления в водном растворе – E(ClO2/ClO2–) = 0.94 ВОксид хлора (IV) имеет нечетное количество электронов (33) и является стабильным радикалом, не проявляющим при нормальных условиях тенденции к димеризации. В газовой фазе ЭПР спектр ClO2 не наблюдается, что объясняется большим числом вращательных уровней его молекулы. ЭПР-спектр раствора оксида хлора (IV) представляет собой широкий синглет, но при некоторых условиях (например, низких температурах) спектральная линия усложняется, превращаясь в широкий квартет вследствие сверхтонкого расщепления на ядрах хлора 35Cl и 37Cl, для которых константы сверхтонкой структуры равны 1.70 ± 0.03 и 1.37 ± 0.03 мT соответственно
Содержание
Получение
В лаборатории получают по реакции:
2KClO3 + H2C2O4 → K2CO3 + 2ClO2↑ + CO2↑ + H2O.
Из-за взрывоопасности диоксид хлора невозможно хранить в виде жидкости. Однако адсрбирование на поверхности силикагеля позволяет хранить диоксид хлора при пониженной температуре достаточно долго, а также избавиться от примесей хлора, силикагелем не поглощающегося.
Промышленный метод получения ClO2 основан на реакции:
2NaClO3 + SO2 + H2SO4 → 2NaHSO4 + 2ClO2↑.
Свойства
Кислотный оксид. При растворении в воде образуются хлористая и хлорноватая кислоты (реакция диспропорционирования). Разбавленные растворы устойчивы в темноте, на свету медленно разлагаются:
- 2ClO2 + H2O → HClO2 + HClO3.
Образующаяся хлористая кислота очень неустойчива и разлагается:
- 5HClO2 → 3HClO3 + Cl2↑ + H2O.
ClO2 реагирует со многими с органическими соединенями и выступает окислителем средней силы. Большинство реакций с участием ClO2 протекают по механизму одноэлектронного окисления с образованием органических катион-радикалов и хлорит-иона на первой стадии реакции, но возможно протекание и других реакций, в частности, отрыва атома водорода.
Применение
Используется в основном для отбеливания и стерилизации различных материалов, например, целлюлозы, бумаги, муки и т. п.
Физиологическое действие

Высоко токсичен и опасен для окружающей среды.
Wikimedia Foundation. 2010.
