- Закон Гесса
-
Закон Гесса — математическое следствие первого начала термодинамики, которое формулируется следующим образом:
- Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы.
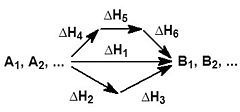
На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
Закон открыт русским химиком Г. И. Гессом в 1840 г.; он является частным случаем первого начала термодинамики применительно к химическим реакциям. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него.
Следствия из закона Гесса
- Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа).
- Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
- Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):
Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т. н. стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры.
- Если начальное и конечное состояния химической реакции (реакций) совпадают, то её (их) тепловой эффект равен нулю.
Литература
- Карапетьянц М. Х. Введение в теорию химических процессов. — М.: Высшая школа, 1981. 304 с.
- Стромберг А. Г., Семченко Д. П. Физическая химия — М.: Высшая школа, 1999. 527 с.
- Даниэльс Ф., Олберти Р. Физическая химия — М.: Мир, 1978. 645 с.
- Пригожин И., Кондепуди Д. Современная термодинамика. От тепловых двигателей до диссипативных структур. — М.: Мир, 2002. 461 с.
- Борисов И. М. Основы электрохимии: учеб. пособие. -Уфа: Изд-во БГПУ, 2009.- 115 с.
Ссылки
Категории:- Химическая термодинамика
- Химические законы и уравнения
Wikimedia Foundation. 2010.