- Потенциал Леннарда-Джонса
-
Потенциал Леннарда-Джонса
Потенциал Леннарда-Джонса (потенциал 6-12) — простая модель парного взаимодействия неполярных молекул, описывающая зависимость энергии взаимодействия двух частиц от расстояния между ними. Эта модель достаточно реалистично передаёт свойства реального взаимодействия сферических неполярных молекул и поэтому широко используется в расчетах и при компьютерном моделировании. Впервые этот вид потенциала был предложен Леннардом-Джонсом в 1924 году.[1]
Содержание
Вид потенциала взаимодействия
Потенциал Леннарда-Джонса записывается в следующем виде:
где r — расстояние между центрами частиц,
 — глубина потенциальной ямы, σ — расстояние, на котором энергия взаимодействия становится равной нулю. Параметры
— глубина потенциальной ямы, σ — расстояние, на котором энергия взаимодействия становится равной нулю. Параметры  и σ являются характеристиками вещества. Характерный вид потенциала показан на рисунке, его минимум лежит в точке
и σ являются характеристиками вещества. Характерный вид потенциала показан на рисунке, его минимум лежит в точке ![r_{min} = \sigma \sqrt[6]{2}](http://dic.academic.ru/pictures/wiki/files/57/9a2cc2419b84545f88c9e976625e5b7e.png) .
.При больших r молекулы притягиваются, что соответствует члену
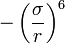 в формуле. Эту зависимость можно обосновать теоретически и обусловлена она силами Ван-дер-Ваальса (диполь-дипольное индуцированное взаимодействие).
в формуле. Эту зависимость можно обосновать теоретически и обусловлена она силами Ван-дер-Ваальса (диполь-дипольное индуцированное взаимодействие).На малых же расстояниях молекулы отталкиваются из-за обменного взаимодействия (при перекрытии электронных облаков молекулы начинают сильно отталкиваться), чему соответствует член
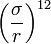 . Данный конкретный вид потенциала отталкивания, в отличие от вида потенциала притяжения, не имеет под собой теоретического обоснования. Более того, более обоснованной является экспоненциальная зависимость. Однако потенциал отталкивания Леннарда-Джонса более удобен в вычислениях, так как
. Данный конкретный вид потенциала отталкивания, в отличие от вида потенциала притяжения, не имеет под собой теоретического обоснования. Более того, более обоснованной является экспоненциальная зависимость. Однако потенциал отталкивания Леннарда-Джонса более удобен в вычислениях, так как 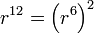 , что и оправдывает его применение.
, что и оправдывает его применение.Различные формы записи
Потенциал Леннарда-Джонса также часто записывается в следующем простейшем виде:
где
Встречается и такая форма записи:
где rmin =
![\sigma \sqrt[6]{2}](http://dic.academic.ru/pictures/wiki/files/102/fb2611d27d11a50ec8830c1a11e614fc.png) — точка минимума потенциала.
— точка минимума потенциала.Термодинамические свойства
Модель Леннарда-Джонса можно использовать при описании газообразной, жидкой и твёрдой фаз вещества. Наименьшее значение свободной энергии для условного вещества, для которого справедлива модель Леннарда-Джонса достигается при гексагональной плотной упаковке. При повышении температуры структура с наименьшей свободной энергией сменяется на кубическую гранецентрированную плотную упаковку, а затем наблюдается переход к жидкости. Под действием давления для структуры с наименьшей энергией происходит переход от кубической плотной упаковки к гексагональной плотной упаковке. [2]
Критическая точка для рассматриваемого условного вещества в безразмерных переменных (
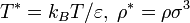 ) лежит при следующих значениях температуры и концентрации: [3]
) лежит при следующих значениях температуры и концентрации: [3]Флигенхарт и Леккеркеркер (Vliegenthart and Lekkerkerker) предложили следующее выражение для связи критической точки и второго вириального коэффициента: [4]
Положение тройной точки было установлено Mastny and de Pablo: [5]
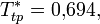
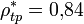 (жидкость);
(жидкость); 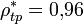 (твёрдое тело).
(твёрдое тело).
Применение в компьютерном моделировании
Оборванный потенциал
Для ускорения расчетов потенциал Леннарда-Джонса часто обрывают на расстоянии rc = 2,5σ. Данный выбор rc = 2,5σ обусловлен тем, что на этом расстоянии значение энергии взаимодействия составляет лишь
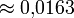 от глубины ямы
от глубины ямы  .
.Однако, простой обрыв потенциала по некоторым соображениям является не лучшим решением. А именно, подобный обрыв означает, что при пересечении сферы радиуса rc какой-то молекулой энергия системы меняется скачком, или, что то же самое, на молекулу действует сколь угодно большие силы. Чтобы избежать этой нефизической ситуации при обрыве потенциала его так же сдвигают, так что выполняется U(rc) = 0:
ULJ(rc) — значение необорванного потенциала Леннарда-Джонса на расстоянии rc.
Приближение сплайнами
Еще одним из способов ускорения вычислений является использование сплайнов. При этом потенциал взаимодействия разбивается на несколько участков, на каждом из которых он приближается простой функцией. Часто используется следующее приближение: [6]
здесь
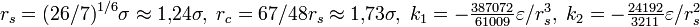 .
.Потенциал m-n
Иногда под потенциалом Леннарда-Джонса подразумевается его более общая форма, а именно:
где
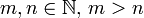 . Коэффициент cm,n выбирается так, чтобы минимальное значение потенциальной энергии U(r) равнялось
. Коэффициент cm,n выбирается так, чтобы минимальное значение потенциальной энергии U(r) равнялось  .
.Экспериментальные методы определения параметров ε и σ
Значения параметров ε и σ для некоторых веществ
Границы применимости
Как уже было сказано, потенциал Леннарда-Джонса описывает парное взаимодействие неполярных сферических молекул, таким образом он не подходит для других типов молекул (несферических и/или имеющих постоянные дипольные моменты). Также следует помнить, что потенциал отталкивания модели является достаточно грубым приближением.
Хотя потенциал Леннарда-Джонса и используется при моделировании жидкости и твёрдых тел, строго говоря, взаимодействие молекул при больших плотностях уже не является парным. В конденсированных средах на рассматриваемую пару молекул влияют молекулы окружения. Так было найдено, что для твёрдого аргона вклад в энергию от тройных взаимодействий может достигать 10 процентов. [7] Однако, учет тройных взаимодействий вычислительно слишком дорог, поэтому обычно довольствуются неким эффективным парным потенциалом, где параметры
 и σ отличаются от таковых для разреженных газов.
и σ отличаются от таковых для разреженных газов.Примечания
- ↑ Lennard-Jones, J. E. — Proc. Roy. Soc., 1924, v. A 106, p. 463.
- ↑ Barron, T. H. K., Domb, C. On the Cubic and Hexagonal Close-Packed Lattices. Proceedings of the Royal Society of London. Series A, Mathematical and Physical Sciences 1955, 227, 447-465.
- ↑ J. M. Caillol " Critical-point of the Lennard-Jones fluid: A finite-size scaling study", Journal of Chemical Physics 109 pp. 4885-4893 (1998)
- ↑ G. A. Vliegenthart and H. N. W. Lekkerkerker "Predicting the gas–liquid critical point from the second virial coefficient", Journal of Chemical Physics 112 pp. 5364-5369 (2000)
- ↑ Ethan A. Mastny and Juan J. de Pablo "Melting line of the Lennard-Jones system, infinite size, and full potential", Journal of Chemical Physics 127 104504 (2007)
- ↑ BL Holian, DJ Evans "Shear viscosities away from the melting line: A comparison of equilibrium and nonequilibrium molecular dynamics" J. Chem. Phys. 78, 5147 (1983); DOI:10.1063/1.445384
- ↑ B. M. Axilord E. Teller "Interaction of the van der Waals' type between three atoms." J. Chem. Phys. 11, 299—300 (1943)
Литература
- Каплан И. Г. Введение в теорию межмолекулярных взаимодействий. — М.: Наука. Главная редакция физико-математической литературы, 1982. 312 с.
- M. P. Allen, D. J. Tildesley Computer Simulation of Liquids — Oxford University Press, 1990 ISBN 0198556454, ISBN 9780198556459
См. также
Ссылки
Wikimedia Foundation. 2010.
Потенциал Леннарда—Джонса — (потенциал 6 12) простая модель парного взаимодействия неполярных молекул, описывающая зависимость энергии взаимодействия двух частиц от расстояния между ними. Эта модель достаточно реалистично передаёт свойства реального взаимодействия… … Википедия
Потенциал Леннард-Джонса — (потенциал 6 12) простая модель парного взаимодействия неполярных молекул, описывающая зависимость энергии взаимодействия двух частиц от расстояния между ними. Эта модель достаточно реалистично передаёт свойства реального взаимодействия… … Википедия
Потенциал Штокмайера — простая модель парного взаимодействия молекул, обладающих постоянным дипольным моментом. Представляет собой потенциал Леннард Джонса с дополнительным членом дипольного взаимодействия. Данная модель была предложена Штокмайером в 1941 году.[1]… … Википедия
Леннард-Джонс — Леннард Джонс, Джон Эдвард Джон Эдвард Леннард Джонс sir John Edward Lennard Jones Дата рождения: 27 октября 1894 … Википедия
Леннард-Джонс, Джон Эдвард — Джон Эдвард Леннард Джонс Sir John Edward Lennard Jones … Википедия
Метод классической молекулярной динамики — Метод молекулярной динамики (метод МД) метод, в котором временная эволюция системы взаимодействующих атомов или частиц отслеживается интегрированием их уравнений движения[1][2][3] Содержание 1 Основные положения … Википедия
Классическая молекулярная динамика — Метод молекулярной динамики (метод МД) это метод, в котором временная эволюция системы взаимодействующих атомов или частиц отслеживается интегрированием их уравнений движения [1] [2] [3] Содержание 1 Основные положения … Википедия
Молекулярная динамика — Метод молекулярной динамики (метод МД) это метод, в котором временная эволюция системы взаимодействующих атомов или частиц отслеживается интегрированием их уравнений движения [1] [2] [3] Содержание 1 Основные положения … Википедия
Радиус Ван-дер-Ваальса — Ван дер ваальсовы радиусы определяют эффективные размеры атомов благородных газов. Кроме того, ван дер ваальсовыми радиусами считают половину межъядерного расстояния между ближайшими одноимёнными атомами, не связанными между собой химической… … Википедия
Ближний порядок — Ближний порядок упорядоченность во взаимном расположении атомов или молекул в веществе, которая (в отличие от дальнего порядка) повторяется лишь на расстояниях, соизмеримых с расстояниями между атомами, то есть ближний порядок это наличие… … Википедия


![U(r) = 4\varepsilon \left[ \left(\frac{\sigma}{r}\right)^{12} - \left(\frac{\sigma}{r}\right)^{6} \right],](http://dic.academic.ru/pictures/wiki/files/52/4ecd4f1428dfd58449c4d767e8674e71.png)
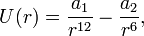
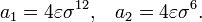
![U(r) = \varepsilon \left[ \left(\frac{r_{min}}{r}\right)^{12} - 2\left(\frac{r_{min}}{r}\right)^{6} \right],](http://dic.academic.ru/pictures/wiki/files/98/b446799f0e39714fdbf92b085ac2245f.png)
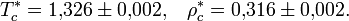

![\begin{cases}
U(r)=4 \varepsilon \left[ \left( \frac{\sigma}{r} \right)^{12} - \left( \frac{\sigma}{r} \right)^6 \right] - U_{LJ}(r_c) & r \leqslant r_c, \\
0 & r > r_c,
\end{cases}](http://dic.academic.ru/pictures/wiki/files/99/caea7ea65d067c98141818969bdb7bbd.png)
![\begin{cases}
U(r)=4 \varepsilon \left[ \left( \frac{\sigma}{r} \right)^{12} - \left( \frac{\sigma}{r} \right)^6 \right] & r \leqslant r_s, \\
k_1 (r-r_c)^3 + k_2 (r-r_c)^2 & r_s<r \leqslant r_c \\
0 & r > r_c,
\end{cases}](http://dic.academic.ru/pictures/wiki/files/98/bce88e42da29c22121bcff78d347dc68.png)
![U(r) = c_{m,n} \varepsilon \left[ \left( \frac{\sigma}{r} \right)^m - \left( \frac{\sigma}{r} \right)^n \right].](http://dic.academic.ru/pictures/wiki/files/52/453fafd4b103841c3a653a67f3c76bed.png)