- Пептиды
-
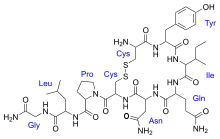 Пример пептидной молекулы — гормон окситоцин.
Пример пептидной молекулы — гормон окситоцин.
Пептиды (греч. πεπτος — питательный) — семейство веществ, молекулы которых построены из остатков α-аминокислот, соединённых в цепь пептидными (амидными) связями —C(O)NH—.
Это природные или синтетические соединения, содержащие десятки, сотни или тысячи мономерных звеньев — аминокислот. Полипептиды состоят из сотен аминокислот, в противоположность олигопептидам, состоящим из небольшого числа аминокислот (не более 10-50), и простым пептидам (до 10).
В 1900 году немецкий химик-органик Герман Эмиль Фишер выдвинул гипотезу о том, что пептиды состоят из цепочки аминокислот, образованных определёнными связями. И уже в 1902 году он получил неопровержимые доказательства существования пептидной связи, а к 1905 году разработал общий метод, при помощи которого стало возможным синтезировать пептиды в лабораторных условиях.
Постепенно учёные изучали строение различных соединений, разрабатывали методы разделения полимерных молекул на мономеры, синтезировали все больше и больше пептидов. На сегодняшний день известно более 1500 видов пептидов, определены их свойства и разработаны методы синтеза.
- Полипептиды могут иметь в молекуле неаминокислотные фрагменты, например углеводные остатки.
- Природные полипептиды с молекулярной массой более 6000 дальтон называют белками.
Содержание
- 1 Терминология: Олигопептиды и Полипептиды
- 2 История
- 3 Терминология по теме
- 4 См. также
- 5 Ссылки
Терминология: Олигопептиды и Полипептиды
Грань между олигопептидами и полипептидами (тот размер, при котором белковая молекула перестаёт считаться олигопептидом и становится полипептидом) достаточно условна. Часто пептиды, содержащие менее 10-20 аминокислотных остатков, называют олигопептидами, а вещества с большим числом аминокислотных звеньев — полипептидами. Во многих случаях эта грань в научной литературе не проводится вообще и небольшая белковая молекула (такая, как окситоцин) упоминается как полипептид (или просто как пептид).
История
Пептиды впервые были выделены из гидролизатов белков, полученных с помощью ферментирования.
- Термин пептид предложен Э. Фишером, который к 1905 г. разработал общий метод синтеза пептидов.
В 1953 В. Дю Виньо синтезировал окситоцин, первый полипептидный гормон. В 1963 г., на основе концепции твердофазного пептидного синтеза (P. Меррифилд) были созданы автоматические синтезаторы пептидов. Использование методов синтеза полипептидов позволило получить синтетический инсулин и некоторые ферменты.
На сегодняшний день известно более 1500 видов пептидов, определены их свойства и разработаны методы синтеза.
Панкреатические молекулы полипептидного характера
Опиоидные пептиды
Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей.Опиоидные пептиды — группа природных и синтетических пептидов, сходных с опиатами (морфин, кодеин и др.) по способности связываться с опиоидными рецепторами организма.
Эндогенные морфиноподобные вещества были впервые выделены в 1975 году из целого мозга и гипофиза голубей, морских свинок, крыс, кроликов и мышей, а в 1976 году фракции таких олигопептидов были обнаружены в спинномозговой жидкости и крови человека . Различные виды этих олигопептидов получили название эндорфинов и энкефалинов.
Лиганды опиоидных рецепторов были обнаружены и во многих периферических органах, тканях и биологических жидкостях. Присутствие опиоидов показано в гипоталамусе и гипофизе, плазме крови и спиномозговой жидкости, желудочно-кишечном тракте, лёгких, органах репродуктивной системы, иммунокомпетентных тканях и даже в коже. Наряду с эндорфинами обнаружены и так называемые экзорфины или параопиоиды — опиоидные пептиды, образующиеся при переваривании пищи. К настоящему времени опиоидные рецепторы и их эндогенные лиганды обнаружены практически во всех органах и тканях млекопитающих, а также у животных более низких ступеней классификации вплоть до простейших.
Основная часть опиоидных пептидов образуется путём внутриклеточного расщепления высокомолекулярных предшественников, что приводит к образованию ряда биологически активных фрагментов, в том числе и опиоидных пептидов. Идентифицированы и наиболее изучены 3 таких предшественника: проопиомеланокортин (ПОМК), проэнкефалин А и продинорфин (проэнкефалин В). В состав ПОМК (локализованного главным образом в гипофизе) входят аминокислотные последовательности b-липотропина, АКТГ, a-, b- и g-меланоцитстимулирующих гормонов, a-, b- и g-эндорфинов. В настоящее время установлено, что основным источником энкефалинов (метионин-энкефалина и лейцин-энкефалина) в организме является проэнкефалин А, локализованный преимущественно в надпочечниках. В его составе содержится 4 аминокислотные последовательности мет-энкефалина и одна лей-энкефалина, а также ряд продленных форм мет-энкефалина: меторфамид, МЕРГЛ (мет-энкефалин-Arg6-Gly7-Leu8), МЕРФ (мет-энкефалин-Arg6-Phe7), пептид Ф и группы родственных пептидов, входящих в состав пептида Е: BAM 22, 20, 18, 12, взаимодействующих с опиоидными рецепторами mu-, kappa- и delta-типа.
В структуре другого проэнкефалина — препроэнкефалина В (или продинорфина) — обнаружены последовательности a- и b-неоэндорфинов, динорфинов [динорфин 1-8, 1-17 (А), динорфин В (риморфин), 4кД-динорфин], обладающих наибольшим сродством к ОР k-типа, а также лей-энкефалина. Радиорецепторный анализ связывания эндорфинов и энкефалинов с опиоидными рецепторами показал, что сродство мет- и лей-энкефалинов к опиоидным рецепторам delta-типа выше, чем к рецепторам mu-типа; b-эндорфин имеет примерно одинаковое сродство к опиоидным рецепторам mu- и delta-типа, a- и g-эндорфины проявляют гораздо меньшее сродство к обоим типам рецепторов по сравнению с b-эндорфином. Несмотря на то, что мет-энкефалин взаимодействует преимущественно с опиоидными рецепторами d-типа, его аналоги с более длинной аминокислотной последовательностью — меторфамид и пептиды группы BAM (пептиды из мозгового вещества надпочечников) обладают противоположным профилем селективности взаимодействия с опиоидными рецепторами (mu > kappa > delta). Большинство эндогенных опиоидов в той или иной степени могут взаимодействовать с несколькими типами рецепторов. Так, b-эндорфин своим N-концевым фрагментом способен взаимодействовать с mu- и delta-опиоидными рецепторами, а С-концом с epsilon-рецепторами. В коже амфибий, а затем и в мозге и некоторых других органах теплокровных, обнаружен 4-й предшественник ОП — продерморфин, который считается источником дерморфина (mu-агониста) и дельторфина (delta-агониста). В ЦНС обнаружены эндогенные пептиды, специфически взаимодействующие с mu-опиоидными рецепторами: Tyr-Pro-Trp-Phe-NH2 и Tyr-Pro-Phe-Phe-NH2, названные эндоморфинами, а также пептид ноцицептин, оказывающий свой анальгетический эффект через опиоидоподобные орфановые рецепторы.Свойства пептидов
Пептиды постоянно синтезируются во всех живых организмах для регулирования физиологических процессов. Свойства пептидов зависят, главным образом, от их первичной структуры — последовательности аминокислот, а также от строения молекулы и её конфигурации в пространстве (вторичная структура).
Классификация пептидов и строение пептидной цепочки
Молекула пептида — это последовательность аминокислот: два и более аминокислотных остатка, соединённых между собой амидной связью, составляют пептид. Количество аминокислот в пептиде может сильно варьировать. И в соответствии с их количеством различают:
- олигопептиды — молекулы, содержащие до десяти аминокислотных остатков; иногда в их названии упоминается количество входящих в их состав аминокислот, например, дипептид, трипептид, пентапептид и др.;
- полипептиды — молекулы, в состав которых входит более десяти аминокислот.
Соединения, содержащие более ста аминокислотных остатков, обычно называются белками. Однако это деление условно, некоторые молекулы, например, гормон глюкагон, содержащий лишь двадцать девять аминокислот, называют белковым гормоном. По качественному составу различают:
- гомомерные пептиды — соединения, состоящие только из аминокислотных остатков;
- гетеромерные пептиды — вещества, в состав которых входят также небелковые компоненты.
Пептиды также делятся по способу связи аминокислот между собой:
- гомодетные — пептиды, аминокислотные остатки которых соединены только пептидными связями;
- гетеродетные пептиды — те соединения, в которых помимо пептидных связей встречаются ещё и дисульфидные, эфирные и тиоэфирные связи.
Цепочка повторяющихся атомов называется пептидным остовом: (—NH—CH—OC—). Участок (—CH—) с аминокислотным радикалом образует соединение (—NH—C(R1)H—OC—), называемое аминокислотным остатком. N-концевой аминокислотный остаток имеет свободную α-аминогруппу (—NH), в то время как у C-концевого аминокислотного остатка свободной является α-карбоксильная группа (OC—). Пептиды различаются не только по аминокислотному составу, но и по количеству, а также расположению и соединению аминокислотных остатков в полипептидную цепочку. Пример: Про-Сер-Про-Ала-Гис и Гис-Ала-Про-Сер-Про Несмотря на одинаковый количественный и качественный состав, эти пептиды имеют совершенно разные свойства.
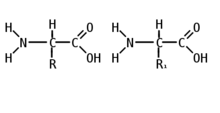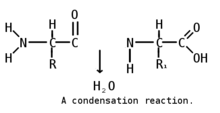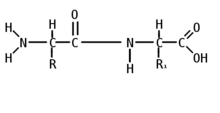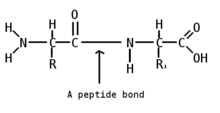
Пептидная связь
Пептидная (амидная) связь — это вид химической связи, которая возникает вследствие взаимодействия α-аминогруппы одной аминокислоты и α-карбоксигруппы другой аминокислоты. Амидная связь очень прочная, и в нормальных клеточных условиях (37 °C, нейтральный ph) самопроизвольно не разрывается. Пептидная связь разрушается при действии на неё специальных протеолитических ферментов (протеаз, пептидгидролаз).
Значение
Пептидные гормоны и нейропептиды, например, регулируют большинство процессов организма человека, в том числе, и принимают участие в процессах регенерации клеток. Пептиды иммунологического действия защищают организм от попавших в него токсинов. Для правильной работы клеток и тканей необходимо адекватное количество пептидов. Однако с возрастом и при патологии возникает дефицит пептидов, который существенно ускоряет износ тканей, что приводит к старению всего организма. Сегодня проблему недостаточности пептидов в организме научились решать. Пептидный пул клетки восполняют синтезированными в лабораторных условиях короткими пептидами.
Синтез пептидов
Образование пептидов в организме происходит в течение нескольких минут, химический же синтез в условиях лаборатории — достаточно длительный процесс, который может занимать несколько дней, а разработка технологии синтеза – несколько лет. Однако, несмотря на это, существуют довольно весомые аргументы в пользу проведения работ по синтезу аналогов природных пептидов. Во-первых, путём химической модификации пептидов возможно подтвердить гипотезу первичной структуры. Аминокислотные последовательности некоторых гормонов стали известны именно благодаря синтезу их аналогов в лаборатории.
Во-вторых, синтетические пептиды позволяют подробнее изучить связь между структурой аминокислотной последовательности и её активностью. Для выяснения связи между конкретной структурой пептида и его биологической активностью была проведена огромная работа по синтезу не одной тысячи аналогов. В результате удалось выяснить, что замена лишь одной аминокислоты в структуре пептида способна в несколько раз увеличить его биологическую активность или изменить её направленность. А изменение длины аминокислотной последовательности помогает определить расположение активных центров пептида и участка рецепторного взаимодействия.
В-третьих, благодаря модификации исходной аминокислотной последовательности, появилась возможность получать фармакологические препараты. Создание аналогов природных пептидов позволяет выявить более «эффективные» конфигурации молекул, которые усиливают биологическое действие или делают его более продолжительным.
В-четвёртых, химический синтез пептидов экономически выгоден. Большинство терапевтических препаратов стоили бы в десятки раз больше, если бы были сделаны на основе природного продукта.
Зачастую активные пептиды в природе обнаруживаются лишь в нанограммовых количествах. Плюс к этому, методы очистки и выделения пептидов из природных источников не могут полностью разделить искомую аминокислотную последовательность с пептидами противоположного или же иного действия. А в случае специфических пептидов, синтезируемых организмом человека, получить их возможно лишь путём синтеза в лабораторных условиях.
Биологически активные пептиды
В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 12 мая 2011.Пептиды, обладая высокой физиологической активностью, регулируют различные биологические процессы. По своему биорегуляторному действию пептиды принято делить на несколько групп:
- соединения, обладающие гормональной активностью (глюкагон, окситоцин, вазопрессин и др.);
- вещества, регулирующие пищеварительные процессы (гастрин, желудочный ингибирующий пептид и др.);
- пептиды, регулирующие аппетит (эндорфины, нейропептид-Y, лептин и др.);
- соединения, обладающие обезболивающим эффектом (опиоидные пептиды);
- органические вещества, регулирующие высшую нервную деятельность, биохимические процессы, связанные с механизмами памяти, обучения, возникновением чувства страха, ярости и др.;
- пептиды, которые регулируют артериальное давление и тонус сосудов (ангиотензин II, брадикинин и др.).
Однако такое деление условно, так как действие многих пептидов не ограничивается каким-либо одним направлением. Так, например, вазопрессин, помимо сосудосуживающего и антидиуретического действия, улучшает память.
Пептидные гормоны
Пептидные гормоны — это многочисленный и наиболее разнообразный по составу класс гормональных соединений, представляющий собой биологически активные вещества. Их образование происходит в специализированных клетках железистых органов, после чего активные соединения поступают в кровеносную систему для транспортировки к органам-мишеням. По достижении цели гормоны специфически воздействуют на определённые клетки, взаимодействуя с соответствующим рецептором.
Нейропептиды
Нейропептиды — соединения, синтезируемые в нейронах, обладающие сигнальными свойствами. Действие нейропептидов на ЦНС очень разнообразно. Они воздействуют непосредственно на мозг и контролируют сон, влияют на память, поведение, процесс обучения, обладают обезболивающим действием.
Тахикининовые пептиды (Tachykinin peptides)
- Субстанция Р
- en:Kassinin
- Нейрокинин А (en:Neurokinin A)
- en:Eledoisin
- Нейрокинин В (en:Neurokinin B)
Пептиды иммунологического действия
Наиболее изученные пептиды, участвующие в иммунном ответе — тафцин, тимопотин II и тимозин α1. Их синтез в клетках организма человека обеспечивает функционирование иммунной системы.
Пептидные биорегуляторы
На основе разработанной петербургскими учеными технологии из органов и тканей животных были выделены пептиды, обладающие тканеспецифическим действием, способные восстанавливать на оптимальном уровне метаболизм в клетках тех тканей, из которых они выделены. Важным отличием этих пептидов является их регулирующее действие: при подавлении функции клетки они её стимулируют, а при повышенной функции – снижают до нормального уровня. Это позволило создать новый класс лекарственных препаратов – пептидные биорегуляторы.
Первый из них – иммуномодулятор тималин – уже более 28 лет находится на фармацевтическом рынке и применяется для восстановления функции иммунной системы при заболеваниях различного генеза, включая онкологические заболевания. За ним последовали эпиталамин (биорегулятор нейроэндокринной системы), сампрост (препарат для лечения заболеваний предстательной железы), кортексин (препарат для лечения широкого спектра неврологических заболеваний), ретиналамин (препарат для лечения дегенеративно-дистрофических заболеваний сетчатки). За 25 лет широкого применения пептидных биорегуляторов их получили более 15 млн человек. При этом не было выявлено противопоказаний к их применению и побочного действия.
Терминология по теме
- Полипептиды простая линейная цепь, состоящая из аминокислот
- Олигопептиды или (просто) пептиды — полипептиды с числом аминокислот в цепи до 30-50
- Дипептиды
- Трипептиды
- Гексапептиды
- Нейропептиды пептиды, ассоциированные с нервной тканью
- Пептидные гормоны — петиды с Гормональной активностью
См. также
Ссылки
Категория:- Пептиды
Wikimedia Foundation. 2010.