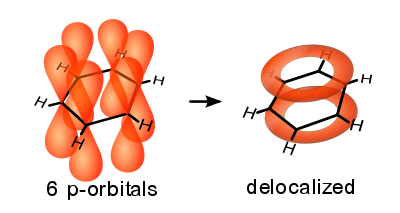- Теория валентных связей
-
Теория валентных связей (метод валентных связей, метод валентных схем, метод локализованных электронных пар) — приближённый квантовохимический расчётный метод, основанный на представлении о том, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар.
Теория валентных связей заложена в 1927 году В.Гайтлером и Ф.Лондоном на примере квантовохимического расчёта молекулы водорода. В основе теории валентных связей лежит гипотеза о том, что при образовании молекулы из атомов, последние в значительной мере сохраняют свою электронную конфигурацию, а связывание атомов достигается в результате обмена электронов между ними и спаривания спинов двух электронов, находящихся на атомных орбиталях исходных атомов. Расчёт Гайтлера — Лондона оказался весьма значительным по своим результатам в развитии квантовой химии. В подтверждение электронной октетной теории (правило октета) Г.Льюиса было показано, что химическая связь в молекуле водорода действительно осуществляется парой электронов.
Электронная пара оказывается размазанной по всему пространству молекулы с различной плотностью, причём на линии связи между ядрами имеется сгущение электронной плотности по сравнению с другими областями пространства. Это сгущение электронной плотности на линии, связывающей ядра атомов, вызывает стягивающее действие на ядра и, соответственно, приводит к образованию химической связи (рис.1). Энергия связи определяется в основном обменным интегралом, величина которого существенно зависит от степени перекрывания атомных орбиталей атомов.
Содержание
Гибридизация атомных орбиталей
 Рис.2.Модель молекулы метана, образованной sp3-гибридными орбиталями
Рис.2.Модель молекулы метана, образованной sp3-гибридными орбиталями
Представление о гибридизации атомных орбиталей занимают центральное место в теории валентных связей. Концепция гибридизации атомных орбиталей была предложена в 1931 году Л.Полингом для объяснения тетраэдрического строения соединений насыщенного атома углерода. По Полингу, смешанные, или гибридные орбитали углерода можно рассчитать с помощью простых алгебраических действий. Для этого важно учесть зависимость электронных s- и p- орбиталей от направления их в пространстве и сложить их так, чтобы гибридные орбитали приняли максимально вытянутую конфигурацию. В тех местах, где гибридные орбитали наиболее вытянутые, как раз и образуются химические связи между атомами. И связи эти направлены от ядра в углы правильного тетраэдра (рис.2).
Позднее Полинг распространил идею гибридизации и на ненасыщенные органические соединения. Так возникли различные виды гибридизации: sp3 — гибридизация используется для описания предельных органических соединений — алканов; sp2 — гибридизация используется для описания непредельных соединений, содержащих двойную связь — алкенов (рис.3); sp — гибридизация используется для описания непредельных соединений, содержащих тройную связь — алкинов (рис.4). Сама гибридизация атомных орбиталей не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить распределение электронной плотности в молекулах при образовании ковалентной химической связи.
Резонанс канонических структур
Резонанс канонических структур — концепция, утверждающая, что если для данного соединения существует несколько приемлемых формул, то действительная структура молекулы определяется сочетанием формул (наложение, резонанс структур). Теория резонанса была развита Л.Полингом в 1928—1931 годах. К теории резонанса тесно примыкает мезомерный эффект — теория электронного строения химических соединений, согласно которой истинное распределение электронной плотности в молекуле является промежуточным между распределениями, представленными несколькими классическими формулами. Для отображения равноудалённости всех связей ввели предположение о делокализации π-связи (π-электронного облака) и отрицательного заряда на все атомы, составляющие молекулу. В качестве примера с делокализованными π-связями обычно приводят молекулу бензола (рис.5).
Взгляды Л.Полинга на квантовую механику применительно к химии, представляющие гибридизацию атомных орбиталей, резонанс несколькоих электронных структур, нашли отражение в его монографии «Природа химической связи».[1]
Лайнус Карл Полинг становится лауреатом Нобелевской премии по химии за 1954 год с формулировкой «За исследование природы химической связи и её применение для определения структуры соединений».
К сожалению, теория валентных связей оставалась умозрительной, физический смысл избирательной гибридизации был неясным. Теория валентных связей не позволяла объяснить образование одноэлектронной химической связи, трёхцентровой двухэлектронной химической связи, многоцентровых химических связей в некоторых металлороганических соединениях.
В настоящее время в квантовой химии доминирует теория молекулярных орбиталей, развитая Р.Малликеном.
В методе молекулярных орбиталей молекула рассматривается как одно целое (учитывается притяжение электрона ко всем ядрам), а не как совокупность отдельных связей. В 1966 году Роберту Сандерсону Малликену присуждена Нобелевская премия по химии с формулировкой «За фундаментальную работу по химическим связям и электронной структуре молекул, проведённую с помощью метода молекулярных орбиталей».
Примечания
- ↑ Паулинг Л. Природа химической связи / Пер. с англ. М. Е. Дяткиной. Под ред. проф. Я. К. Сыркина. — М.; Л.: Госхимиздат, 1947. — 440 с.
Литература
- Паулинг Л. Теория резонанса в химии / ЖВХО. — 1962. — Т. VII. — 462-467 с.
- Быков Г.В. История органической химии (Структурная химия. Физическая органическая химия. Расчётные методы). — М.: "Химия", 1976. — 360 с.
См. также
Категории:- Квантовая химия
- Химическая связь
- Химические теории
Wikimedia Foundation. 2010.