- Пероксид ацетона
-
Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей.Проверить информацию. Необходимо проверить точность фактов и достоверность сведений, изложенных в этой статье.
На странице обсуждения должны быть пояснения.Пероксид ацетона 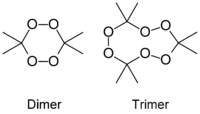

Общие Систематическое наименование 3,3,6,6-тетраметил-1,2,4,5-тетраоксан
(димер)
3,3,6,6,9,9-гексаметил-1,2,4,
5,7,8-гексаоксациклононан
(тример)Химическая формула C6H12O4 (димер)
C9H18O6 (тример)Физические свойства Молярная масса (димер) 148,157 г/моль
(тример) 222,24 г/мольТермические свойства Температура плавления 91 °C Температура кипения 97–160 °C Классификация Рег. номер CAS 17088-37-8 SMILES CC1(OOC(OOC(OO1)(C)C)(C)C)C Пероксид ацетона (перекись ацетона, триперекись ацетона, диперекись ацетона, трициклоацетонпероксид, ТА, ДА, ТЦАП, киса, (3,3,6,6,9,9-гексаметил-1,2,4,5,7,8-гексаоксонан)) — инициирующее взрывчатое вещество, впервые получено в 1885 году Вольфенштейном. Существует в виде тримера и димера. Иногда можно встретить утверждения о существовании мономера и полимера, однако достоверные подтверждения этого неизвестны. В большинстве случаев образуется триперекись, иногда с небольшими примесями диперекиси. Чистая диперекись получается лишь при использовании специальных кислот. Часто можно встретить ошибку, когда триперекись называют диперекисью. Название «киса» является жаргонным, произошло, по всей видимости, от «перекись ацетона», или из-за сильной чувствительности к трению («против шерсти лучше не гладить»).
Содержание
Физические свойства
Представляет собой мелкодисперсное вещество, похожее на муку. После многомесячного хранения или перекристаллизации из растворителя образуются крупные прозрачно-белые кристаллы неправильной формы. Вещество практически нерастворимо в воде, растворимо в ацетоне, эфире. Температура плавления триперекиси — 97 °С, диперекиси — 132 °С.
При комнатной температуре улетучивается с разложением, в открытом сосуде большие количества перекиси могут полностью испариться за десятки минут. При хранении даже в приоткрытом сосуде происходит кристаллизация из паров, что ведёт к росту высокочувствительных кристаллов.
Взрывчатые свойства
К удару менее чувствительна, чем гремучая ртуть, однако более чувствительна, чем азид свинца. Очень чувствительна к трению. Случайное попадание искры (в том числе электростатической от одежды) на порошкообразное вещество вызывает взрыв. В переплавленном (литая) или пластифицированном состоянии резко повышается чувствительность к механическим воздействиям. Идеально приготовленный слиток может сдетонировать, просто если поцарапать его ногтём.
Скорость детонации при плотности 0,92 г/см³ — 3750 м/с, 1,2 г/см³ — 5290 м/с. Способна к перепрессовке, то есть спрессованная под давлением около 2000 кгс/см² уже горит, а не детонирует.
Температура вспышки по Кестеру: 196 °C , по Фичерулью: 210-220 °C
По бризантности превосходит азид свинца и ГМТД, по инициирующей способности превосходит гремучую ртуть, но уступает ГМТД и азиду свинца.
Фугасность 250 мл.
Инициирующая способность для тетрила 0,09;г, для тротила 0,18;г.
Уравнение взрывчатого разложения:
(C3H6O2)3 = 1,3 CO2 + 2,44 CO + 2,61 CH4 + 0,63 C2H6 + 0,23 C4H4 + 0,47 H2 + 0,96 H2O + 0,47 C
Небольшие количества на открытой поверхности сгорают большим, объёмным пламенем, с глухим звуком хлопка. В количествах более 10 г и/или запрессованная в бумажный корпус оглушительно детонирует.
Не взаимодействует с большинством металлов, однако свинец является катализатором разложения перекисей и может привести к самоподрыву, поэтому контакт перекисей ацетона с ним опасен. Соли переходных металлов (железо, хром, марганец) также являются катализаторами разложения перекиси ацетона.
Получение
Перекись ацетона получают путём воздействия пероксида водорода на ацетон в кислой среде. Реакция отличается малой требовательностью к условиям. Для получения кислой среды используются разнообразные минеральные кислоты. Как правило, рекомендуется использование соляной кислоты, однако реакция идёт и при использовании азотной, ортофосфорной, серной, надсерной и других кислот. В случае использования серной кислоты образуется триперекись с примесями диперекиси, в случае надсерной кислоты — диперекись. В остальных случаях образуется триперекись ацетона
Применение
Промышленого применения в качестве инициирующего взрывчатого вещества не получила, из-за склонности к росту размеров кристаллов (см. выше), что повышает её чувствительность. В кустарных условиях часто приготовляется различного рода пиротехниками и преступниками в разрез со ст.222 УК РФ (и аналогичных статей УК других стран). Очень часто приводит к травматизации различной степени тяжести в процессе как приготовления, так и использования, поскольку химически неустойчива и склонна к самопроизвольному распаду со взрывом. Наиболее опасны подкисленные и недостаточно хорошо промытые от кислоты порошки данного вещества нестабильность которых намного выше. Взрыв 5 грамм перекиси ацетона вблизи человека уже способен нанести непоправимый вред его здоровью.
- Растворённая в эфире применяется в боеприпасах объёмного взрыва.
- В химической промышленности применяется в качестве инициатора реакций свободнорадикальной полимеризации.
- Имеются сведения о использовании перекиси ацетона в качестве консерванта пищевых продуктов.
- В пищевой промышленности зарегистрирован в качестве пищевой добавки E929.
Для улучшения этой статьи желательно?: - Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
- Обновить статью, актуализировать данные.
- Проверить достоверность указанной в статье информации.
- Исправить статью согласно стилистическим правилам Википедии.
Категории:- Взрывчатые вещества
- Инициирующие взрывчатые вещества
- Пищевые добавки
Wikimedia Foundation. 2010.

