- Циановодород
-
Синильная кислота 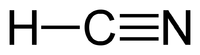

Общие Систематическое наименование циановодород, синильная кислота Химическая формула HCN Отн. молек. масса 27,02 а. е. м. Молярная масса 27,02 г/моль Физические свойства Плотность вещества 0.687 г/см³ Состояние (ст. усл.) жидкость Термические свойства Температура плавления −13,3 °C Температура кипения 26,7 °C Энтальпия (ст. усл.) 95 кДж/моль Химические свойства Растворимость в воде в любых пропорциях г/100 мл Классификация номер CAS [74-90-8] Сини́льная кислота́ (цианистый водород, нитрил муравьиной кислоты) HCN — бесцветная легкоподвижная жидкость с запахом горького миндаля. Молекула HCN сильно полярна (μ = 0,96·10-29 Кл·м). Циановодород состоит из молекул двух видов, находящихся в таутомерном равновесии (превращение циановодорода в изоциановодород), которое при комнатной температуре смещено влево:
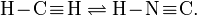
Большая стабильность первой структуры обусловлена меньшими значениями эффективных зарядов атомов
Безводная синильная кислота является сильно ионизирующим растворителем, растворенные в нем электролиты хорошо диссоциируют на ионы. Его относительная диэлектрическая проницаемость при 25° С равна 107 (выше, чем у воды). Это обусловлено линейной ассоциацией полярных молекул HCN за счет образования водородных связей.
Синильная кислота содержится в некоторых растениях, коксовом газе, табачном дыме, выделяется при термическом разложении нейлона, полиуретанов.
Содержание
Свойства
Очень слабая одноосновная кислота К = 1,32·10-9 (18 °C). Образует с металлами соли — цианиды. Взаимодействует с оксидами и гидроксидами щелочных и щелочно-земельных металлов.
Пары синильной кислоты горят на воздухе фиолетовым пламенем с образованием Н2О, СО2 и N2. В смеси кислорода со фтором горит с выделением большого количества тепла:
2HCN + O2 + F2 = 2HF + 2CO + N2 + 1020kJ.
Синильная кислота широко применяется в органическом синтезе. Она реагирует с карбонильными соединениями, образуя цианогидриды:
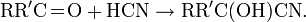
С галогеналканами образует нитрилы (реакция Кольбе):
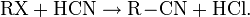
С алкенами и алкинами реагирует, присоединяясь к кратным связям:
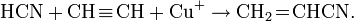
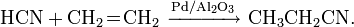
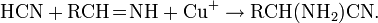
Легко полимеризуется в присутствии основания (часто со взрывом). Образует аддукты, напр. HCN-CuCl.
Получение
В настоящий момент есть три наиболее распространенных метода получения синильной кислоты в промышленных масштабах:
- Метод Андрусова: прямой синтез из аммиака и метана в присутствии воздуха и платинового катализатора при высокой температуре:
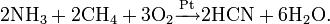
- Метод BMA (Blausäure aus Methan und Ammoniak), запатентованный фирмой аммиака и метана в присутствии платинового катализатора при высокой температуре:
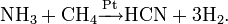
- Побочный продукт при производстве акрилонитрила путем окислительного аммонолиза пропилена.
Применение
Является сырьём для получения акрилонитрила, метилметакрилата, адипонитрила и других соединений.
В медицине в малых дозах (!) используется как сильное седативное средство.
Соли
Соли синильной кислоты называются цианидами. Цианиды подвержены сильному гидролизу. При хранении водных растворов цианидов при доступе диоксида углерода они разлагаются:
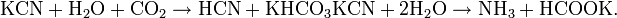
Ион CN- (изоэлектронный молекуле СО) входит как лиганд в большое число комплексов d-элементов. Комплексные цианиды в растворах очень стабильны.
Цианиды тяжёлых металлов термически неустойчивы, в воде, кроме цианида ртути Hg(CN)2, нерастворимы. При окислении цианиды образуют цианаты:
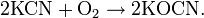
Многие металлы при действии избытка цианида калия или цианида натрия дают комплексные соединения, что используется, например, для извлечения золота и серебра из руд:
![\mathrm {4NaCN + 2Au + {1 \over 2}O_2 + H_2O \rightarrow 2Na[Au(CN_2)] + 2NaOH}.](/pictures/wiki/files/50/21b9b9072bba94314044dc4124ef893e.png)
Биологические свойства
Синильная кислота — очень сильный яд общетоксического действия, блокирует клеточную цитохромоксидазу, в результате чего возникает выраженная тканевая гипоксия. Смертельная доза (LD50) синильной кислоты — 50 мг, подкожно — 1 мг/кг.
При вдыхании небольших концентраций синильной кислоты наблюдается царапанье в горле, горький вкус во рту, головная боль, тошнота, рвота, боли за грудиной. При нарастании интоксикации уменьшается частота пульса, усиливается одышка, развиваются судороги, наступает потеря сознания. При этом цианоз отсутствует (содержание кислорода в крови достаточное, нарушена его утилизация в тканях).
При вдыхании высоких концентраций синильной кислоты или при попадании её внутрь появляются клонико-тонические судороги и почти мгновенная потеря сознания вследствие паралича дыхательного центра. Смерть может наступить в течение нескольких минут.
Боевое отравляющее вещество
Впервые в роли боевого отравляющего вещества синильная кислота была использована французской армией 1 июля 1916 года. Однако по ряду причин, как то:
- использование немецкой армией газовых масок с фильтрами
- быстрый унос газообразной синильной кислоты ветром с поля боя
последующее использование синильной кислоты в этой роли прекратилось.
Отравляющее вещество
В некоторых странах синильная кислота используется в газовых камерах в качестве отравляющего вещества при исполнении приговоров смертной казни. Делается это из соображений минимального расхода газа. Смерть как правило наступает в течение 4-10 минут, в отдельных случаях продолжительность казни достигает 17 минут.
Антидот
Для лечения отравлений синильной кислотой известно несколько антидотов, которые могут быть разделены на две группы. Лечебное действие одной группы антидотов основано на их взаимодействии с синильной кислотой с образованием нетоксичных продуктов. К таким препаратам относятся, например, коллоидная сера и различные политионаты, переводящие синильную кислоту в малотоксичную роданистоводородную кислоту, а также альдегиды и кетоны (глюкоза, диоксиацетон и др.), которые химически связывают синильную кислоту с образованием циангидринов. К другой группе антидотов относятся препараты, вызывающие образование в крови метгемоглобина: синильная кислота связывается метгемоглобином и не доходит до цитохромоксидазы. В качестве метгемоглобинообразователей применяют метиленовую синь, а также соли и эфиры азотистой кислоты.
Сравнительная оценка антидотных средств: метиленовая синь предохраняет от двух смертельных доз, тиосульфат натрия и тетратиосульфат натрия — от трех доз, азотистокислый натрий и этилнитрит — от четырех доз, метиленовая синь совместно с тетратиосульфатом — от шести доз, амилнитрит совместно с тиосульфатом — от десяти доз, азотистокислый натрий совместно с тиосульфатом — от двадцати смертельных доз синильной кислоты.
Литература
- Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. М.: Химия 1994
Wikimedia Foundation. 2010.
